肖俊宇研究组揭示FcRL5受体识别 IgG的分子机制
免疫球蛋白,也称为抗体,是体液免疫反应的核心组成部分。人体中免疫球蛋白可分为五类:IgM、IgD、IgG、IgE和IgA。在先前的研究中,北京大学肖俊宇研究组对IgM、IgA和IgE的分子机制进行了深入研究,阐明了它们的组装机制及其与受体或病原体蛋白的相互作用机制,为理解这些抗体的功能提供了新的视角[1-6]。
IgG是人类血清中含量最高的抗体,其Fc区域能够与多种效应分子相互作用,包括FcγR、C1q、FcRn和TRIM21,从而介导吞噬作用、细胞毒性、转胞吞作用、延长抗体半衰期,以及通过蛋白酶体清除被抗体包被的病原体等多种功能[7]。深入理解IgG-Fc与这些效应分子的作用机制,为治疗性抗体的设计与优化提供了重要依据[8]。
FcRL5(也称FcRH5或IRTA2)属于Fc受体样家族(Fc receptor-like family),与经典FcγR具有结构同源性[9]。FcRL5是该家族中最大的成员,包含9个Ig样结构域(D1–D9)、跨膜区以及同时具备活化与抑制基序的胞内结构。FcRL5仅在B细胞上表达,在初始B细胞、记忆B细胞和浆细胞中最为丰富,并作为BCR的共受体对B细胞功能发挥双向调节作用[10-12]。此外,FcRL5在多种B细胞恶性肿瘤中高表达,目前有多种以FcRL5为靶点的多发性骨髓瘤治疗策略正在研发中[13-15]。FcRL5被认为可以通过其前三个Ig样结构域(D1–D3)结合热聚集的IgG[16],但其在生理条件下是否是真正的 IgG受体,以及其识别IgG的具体分子机制仍不清楚。
2026年1月2日,肖俊宇研究组在Science Advances期刊发表题为“Human FcRL5 is an Fc receptor that simultaneously engages two IgGs”的研究论文,揭示人源FcRL5以一种依赖于亲合力(avidity)的独特方式识别IgG,同时结合两分子IgG,为其受体功能及生物学意义提供了重要的分子基础。
鉴于之前报道FcRL5能结合热聚集的IgG,研究团队首先考虑热聚集的IgG是否反映了IgG多聚体。已知IgG在结合高密度膜抗原后可发生天然六聚体化,这一过程对补体依赖的细胞毒性(complement-dependent cytotoxicity, CDC)至关重要。之前,肖俊宇研究组从非洲爪蟾中的IgX抗体得到了启发,开发了一种适用于构建人源IgM和IgG六聚体的策略[17]。基于这一思路,研究团队制备了IgG1-Fc六聚体并开展pull-down实验。结果显示,FcRL5对六聚体化的IgG1-Fc具有显著结合能力,而对单体形式的结合则并不明显。相比之下,经典FcγR(如FcγRIIA、FcγRIIB和FcγRIIIA)在相同条件下均能有效结合IgG1-Fc单体,体现出两类受体在识别机制上的本质差异。进一步实验表明,小鼠FcRL5不与小鼠IgG-Fc六聚体结合,因此不应被视为人源FcRL5的功能对应物。
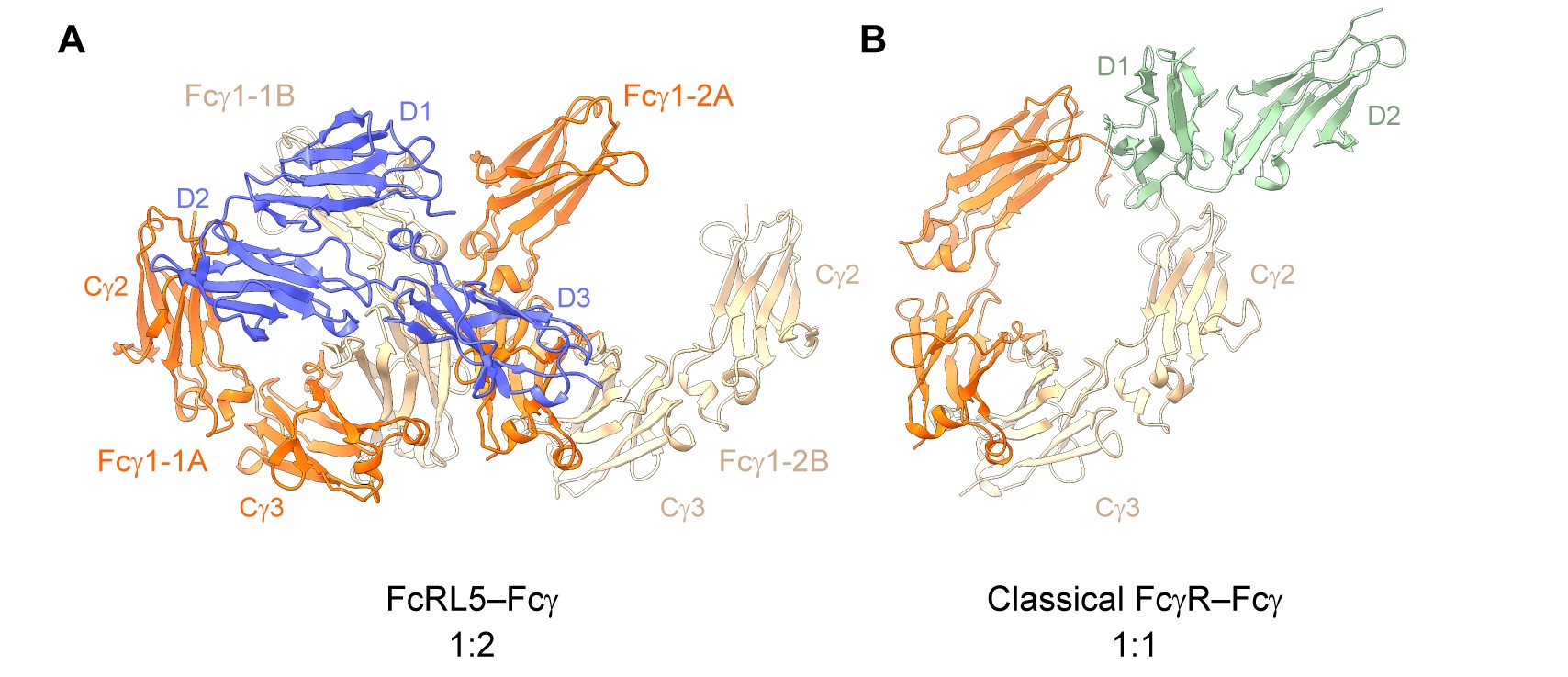
图1. FcRL5–IgG-Fc和经典FcγR–IgG-Fc的结合模式比较
随后,研究团队利用冷冻电镜解析了FcRL5和IgG1-Fc复合物的结构(图1A)。结果显示,FcRL5的D1–D3结构域同时与两个Fc分子发生作用:D1–D2结构域结合第一个Fc分子,而D3结构域结合第二个Fc分子。也就是说,只有当两个Fc分子在空间上足够接近时才能与FcRL5形成稳定而高亲和力的结合。这一“1:2”双配体识别模式与经典FcγR的“1:1”识别模式截然不同,体现出FcRL5独特的受体特性(图1)。
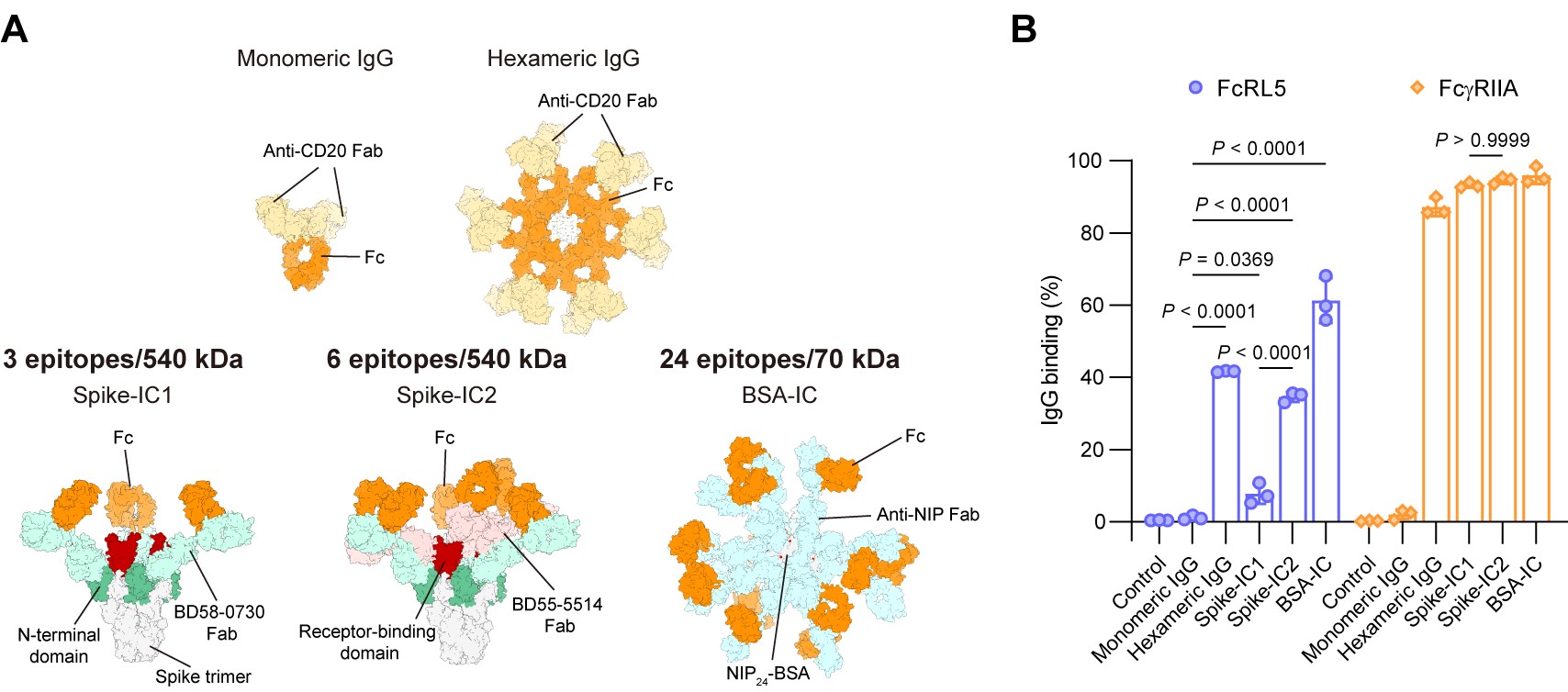
图2. FcRL5“感知”免疫复合物中IgG的密度
研究团队进一步推测,在由多抗原和多抗体构成的免疫复合物(immune complexes, ICs)中,一些IgG-Fc同样会因空间接近而满足FcRL5的识别需求。为此,研究者构建了三种IgG免疫复合物(图2A),并根据抗原表位数量与分子量的比值,推断免疫复合物中IgG的密度排序为:Spike-IC1 < Spike-IC2 < BSA-IC。经检测,三种免疫复合物与细胞表面FcRL5的结合强度与IgG密度呈明显正相关,即Spike-IC1结合最弱,Spike-IC2显著增强,而BSA-IC显示最强信号(图2B)。相比之下,经典受体FcγRIIA则能与所有多价IgG复合物强力结合。这些结果说明,经典FcγR与多价IgG复合物的结合仅取决于单价亲和力和IgG分子的数量,而FcRL5的结合还受到IgG-Fc的局部密度与空间排列的影响。正是这种独特的结合模式赋予了FcRL5“感知”免疫复合物中IgG密度的能力。进一步实验显示,FcRL5与不同IgG亚类所构成的免疫复合物均能结合。此外,共聚焦分析表明FcRL5能介导IgG免疫复合物的内化,并将其运送至溶酶体。
总结而言,这项研究明确定义了人源FcRL5是一个真正的IgG-Fc受体,揭示了一种依赖 “亲合力”的独特识别模式。这一机制不仅拓展了我们对B细胞信号调控的理解,也为治疗性IgG抗体的设计与优化提供了新的思路与方向。
北京大学前沿交叉学科研究院2020级博士研究生陈诗婳(PTN项目)、北京大学生命科学学院2023级博士研究生李姝涵和已毕业博士张志莹(PTN项目)为该论文的共同第一作者。肖俊宇教授(基因功能研究与操控全国重点实验室、北京大学生命科学学院/BIOPIC、北大清华生命科学联合中心)为该论文的通讯作者。该研究得到了国家自然科学基金委、国家重点研发计划、北京大学生命科学学院启东产业创新基金、北京大学成都前沿交叉生物技术研究院创新基金的资助。北京大学冷冻电镜平台、昌平实验室冷冻电镜平台、北京大学生命科学学院仪器中心为该研究提供了重要支持。
原文链接:
https://www.science.org/doi/10.1126/sciadv.aeb8865
参考文献:
[1] Li, Y. et al., Structural insights into immunoglobulin M. Science 367, 1014-1017 (2020).
[2] Li, Y. et al., Immunoglobulin M perception by FcmuR. Nature 615, 907-912 (2023).
[3] Ji, C. et al., Plasmodium falciparum has evolved multiple mechanisms to hijack human immunoglobulin M. Nature Communications 14, 2650 (2023).
[4] Wang, Y. et al., CD5L associates with IgM via the J chain. Nature Communications 15, 8397 (2024).
[5] Wang, Y. et al., Structural insights into secretory immunoglobulin A and its interaction with a pneumococcal adhesin. Cell Research 30, 602-609 (2020).
[6] Deng, M. et al., Structural insights into the high-affinity IgE receptor FcεRI complex. Nature 633, 952-959 (2024).
[7] Bruhns, P. & Jonsson, F., Mouse and human FcR effector functions. Immunol Rev 268, 25-51 (2015).
[8] Delidakis, G. et al., Improving Antibody Therapeutics by Manipulating the Fc Domain: Immunological and Structural Considerations. Annu Rev Biomed Eng 24, 249-274 (2022).
[9] Davis, R. S., Fc receptor-like molecules. Annu Rev Immunol 25, 525-560 (2007).
[10] Polson, A. G. et al., Expression pattern of the human FcRH/IRTA receptors in normal tissue and in B-chronic lymphocytic leukemia. Int Immunol 18, 1363-1373 (2006).
[11] Haga, C. L. et al., Fc receptor-like 5 inhibits B cell activation via SHP-1 tyrosine phosphatase recruitment. Proc Natl Acad Sci U S A 104, 9770-9775 (2007).
[12] Dement-Brown, J. et al., Fc receptor-like 5 promotes B cell proliferation and drives the development of cells displaying switched isotypes. J Leukoc Biol 91, 59-67 (2012).
[13] Stewart, A. K. et al., Phase I study of the anti-FcRH5 antibody-drug conjugate DFRF4539A in relapsed or refractory multiple myeloma. Blood Cancer J 9, 17 (2019).
[14] Li, J. et al., Membrane-Proximal Epitope Facilitates Efficient T Cell Synapse Formation by Anti-FcRH5/CD3 and Is a Requirement for Myeloma Cell Killing. Cancer Cell 31, 383-395 (2017).
[15] Jiang, D. et al., Chimeric antigen receptor T cells targeting FcRH5 provide robust tumour-specific responses in murine xenograft models of multiple myeloma. Nat Commun 14, 3642 (2023).
[16] Wilson, T. J. et al., Cutting edge: human FcRL4 and FcRL5 are receptors for IgA and IgG. J Immunol 188, 4741-4745 (2012).
[17] Zhang, R. et al., Xenopus IgX informs engineering strategies of IgM and IgG hexamers. Science Advances 11, eaea3737 (2025).
- 张蔚课题组与合作者揭示红珠凤蝶马兜铃酸抗性机制2026.01.05
- 刘君团队开发FOCAS平台实现m6A修饰位点的全转录组功能解析2026.01.05
- 肖俊宇研究组揭示FcRL5受体识别 IgG的分子机制2026.01.02
- 王伟课题组报道应激颗粒实现胞内氧化还原异质性的新功能:细胞抗氧化的“智能调控枢纽”2025.12.22
- 李晟课题组与合作者揭示保护地缓解人类对兽类行为干扰的关键作用2025.12.15
- 姚蒙研究组系统评估无脊椎动物宏条形码引物,助力eDNA生物多样性研究2025.12.12
- 朱丹萌课题组与合作者揭示PICKLE调控染色质状态与基因转录的分子机理2025.12.09
- 季雄团队提出FeaSion策略揭示RNA聚合酶磷酸化的特征调控与功能2025.12.01
- 罗述金课题组古DNA研究揭示:豹猫与人共栖3500年直至汉末,家猫经丝绸之路唐代方始传入2025.11.28
- 白洋研究员入选第三期 “新基石研究员项目”资助名单2025.11.26
- 实验室主任瞿礼嘉教授2025年新当选中国科学院院士2025.11.25
- 汪阳明团队与西湖大学卢培龙团队利用人工智能辅助蛋白质设计实现精准线粒体DNA碱基编辑2025.11.18
- 肖俊宇和高宁团队联合发表多聚抗体设计策略2025.11.07
- 赵进东课题组应邀撰写藻胆体的结构和能量传递机制长文综述2025.10.28
- 郑晓峰课题组揭示代谢酶ALDOA入核激活NF-κB信号通路驱动胰腺癌进展2025.10.23
- 陆剑课题组揭示果蝇饥饿耐受的遗传架构和性别差异2025.09.29
- 遇赫课题组揭示中国家猪的起源传播与人群互动过程2025.09.26
- 季雄团队揭示INO80/SWR复合物通过BRD2和染色质景观调控Pol II转录起始2025.09.22
- 刘启昆课题组与合作者在Current Opinion in Plant Biology发文总结植物再生领域表观遗传调控的研究进展2025.09.18
- 钟上威课题组受邀发表植物光信号传导Tansley长文综述2025.09.16
- 姚蒙课题组研发新型空气eDNA采集器高效检测动植物多样性2025.09.11
- 焦雨铃研究组克隆了小麦粒重新基因,服务高产育种2025.09.02
- 魏文胜团队与合作者联合开发新型通用型CAR-T 疗法治疗血液系统恶性肿瘤2025.08.22
- 魏文胜团队开发RNA环化新方法2025.08.12
- 汪阳明团队创新双组学技术MAPIT-seq:在单细胞水平同时绘制RNA结合蛋白作用图谱与基因表达图谱的新利器2025.08.11
- 周岳课题组揭示拟南芥PRC1介导的H2Aub loop的形成机制及功能2025.08.11
- 贺新强课题组与周岳课题组合作揭示PRC2调控维管组织模式建立机制2025.08.11
- 苏晓东课题组揭示清道夫受体CD163识别底物的分子机制2025.07.23
- 陈雪梅课题组系统阐释植物miRNA成熟与功能调控机制2025.07.23
- 苏晓东课题组与合作者揭示AAV与新型受体(AAVR2)结合的分子机制2025.07.15
- 合成植物基因组2025.07.09
- 伊成器课题组与合作者建立RNA"暗码",升级生命语言2025.07.04
- 魏文胜团队系统揭秘人类基因组中“沉默突变”的功能性“低语”2025.06.26
- 肖俊宇团队与张永辉团队合作揭示嗜乳脂蛋白激活γδ T细胞的“分子钳”机制2025.06.12
- 昌增益课题组揭示蛋白质内源性(顺式)去组装元件调控细菌细胞分裂环(Z环)的动态形成2025.06.09
- 陆剑课题组揭示uORF在动物进化与发育中发挥“翻译减震器”调控作用的新机制2025.06.09
- 张蔚课题组与合作者揭示兰花螳螂程序性体色转变的分子机制及生态学意义2025.05.30
- 2025年“全国科技活动周”和“全国科技工作者日”活动2025.05.29
- 李川昀团队与合作者开发细胞通讯分析工具STCase,揭示肿瘤微环境中空间特异性通讯事件2025.05.29
- 伊成器课题组系统阐释假尿嘧啶修饰的功能与治疗应用新范式2025.05.27
- 瞿礼嘉/钟声团队应邀撰写被子植物雌-雄相互作用保证双受精成功综述2025.05.26
- 陆剑课题组与合作者共同揭示uORFs通过精细调节CLOCK蛋白的翻译参与果蝇昼夜节律及睡眠行为的调控机制2025.05.16
- 伊成器团队发展痕量样品m6A修饰定量测序方法2025.05.08
- 白洋团队联合多位顶尖科学家系统解析根际微生物组调控水稻分蘖的功能与机制2025.04.24
- 瞿礼嘉/钟声课题组发现植物传粉过程中“未雨绸缪”的“两步授粉”备份新机制,为作物逆境下的育性优化提供新思路2025.04.15
- 曾虎课题组应邀撰写综述:空间组学技术的研究进展2025.04.06
- 张迪课题组受邀综述蛋白质L-乳酰化的研究进展2025.04.04
- 苏晓东课题组揭示短序列锚定元件AE在DNA与蛋白质结合中的重要作用2025.03.31
- 魏文胜团队实现人类肿瘤免疫调控网络的单碱基精度解析2025.03.21
- 白洋团队构建全球首个作物根际"细菌+病毒"基因组数据库2025.03.13
- 季雄团队揭示RNA聚合酶亚基RPB7偶联磷酸酶CTDP1稳定Pol II并介导转录再起始2025.03.05
- 何爱彬团队利用全景单细胞组蛋白修饰实现胚胎发育谱系追踪2025.03.04
- 赵进东课题组揭示蓝细菌藻胆体与光系统II结合的新分子机制2025.02.17
- 高歌课题组提出面向大规模异质性空间转录组学切片的表征与解析新方法2025.02.12
- 周岳课题组揭示拟南芥雄性生殖细胞发育过程中染色质三维结构的动态变化过程及其重要作用2025.02.12
- 魏文胜团队发布新一代线粒体碱基编辑器助力建立疾病动物模型2025.01.23
- 贺新强课题组揭示木质部管状分子发育的microRNA调控网络2025.01.19
- 周岳课题组在Genome Biology发文揭示了拟南芥中启动子空间调控模式和喷泉结构形成机制2025.01.02
- 高歌课题组提出人类转录调控元件建模与相关非编码变异功能解析方法2025.01.02
- 魏文胜团队利用碱基编辑器筛选绘制DNA损伤应答功能元件图谱2024.12.16
- 秦跟基课题组揭示弱光下种子萌发调控新机制2024.12.05
- 刘启昆课题组开发了全新的植物细胞谱系追踪工具2024.11.26
- 周岳课题组揭示植物首个三维基因组结构蛋白及其调控机制2024.11.22
- 周岳课题组揭示植物特有的PWWP结构域蛋白调控基因表达的分子机制2024.11.22
- 国家重点实验室陈雪梅教授获得2024年度“求是杰出科学家奖”2024.11.08
- 秦跟基课题组应邀撰写品牌综述“Tansley insight”总结TCP转录因子在细胞器、细胞和器官命运决定中的重要功能2024.10.28
- 郑晓峰课组揭示USP1-ATF4-CD98hc调控ENKTL淋巴瘤患者耐药的新机制2024.09.30
- 肖俊宇课题组揭示IgM–CD5L复合物的分子机制2024.09.30
- 陆剑课题组揭示密码子使用偏好性对翻译调控的影响2024.09.30
- 魏文胜团队实现蛋白质组中丝氨酸、苏氨酸和酪氨酸位点的功能解析2024.09.24
- 王继纵/邓兴旺课题组合作解析植物光敏色素phyB光信号转导的机制2024.09.24
- 刘君/杨雪瑞课题组合作揭示m6A-cenRNA调控癌细胞着丝粒稳态的机制2024.09.23
- 伊成器教授荣获2024年“科学探索奖”2024.08.29
- 王伟课题组报道蛋白酶体调控SG稳态抵御高温胁迫的新机制2024.08.22
- 肖俊宇团队阐明IgE 高亲和力受体FcεRI 复合物的组装机制2024.08.22
- 朱玉贤院士团队发布首个棉花基因组完整图谱,阐述棉族独特折叠胚胎形成的分子与演化机制2024.08.16
- 李晴课题组报道了滞后链核小体组装和冈崎片段成熟的协同机制2024.08.13
- 魏文胜团队报道非脱氨酶依赖的嘧啶碱基编辑器TBE2024.08.03
- 李晴研究组与合作者报道真核DNA复制体介导的亲本组蛋白表观遗传信息继承新机制2024.08.02
- 张迪课题组与合作者共同报道区分蛋白质乳酰化修饰同分异构体的新方法2024.07.22
- 国际遗传工程和生物技术中心(ICGEB)总干事Lawrence Banks教授一行访问陆剑课题组2024.06.26
- 郭强课题组与合作者揭示Synaptophysin调控突触小泡生成与功能的机制2024.06.06
- 2024年全国科技周开放活动2024.05.28
- 李磊课题组解析miR408平衡植物生长和抗旱的分子机制2024.05.16
- 李晟课题组与合作者研究揭示华北地区华北豹栖息地及其景观连通性现状2024.05.06
- 陆剑课题组揭示黑腹果蝇演化历史和环境适应机制2024.04.19
- 李川昀课题组在WIRES RNA发表从头起源新基因起源特征的综述2024.04.16
- 秦跟基课题通过构建拟南芥十二重突变体揭示雌蕊顶端命运决定的分子机制2024.04.08
- 李川昀课题组与合作者揭示结构变异编码人脑特异发育的新机制2024.04.07
- 肖俊宇课题组阐明磷酸化酶激酶PhK的组装与激活机制2024.04.01
- 陆剑课题组研发SIRSVIDE模型解析病毒进化动态2024.03.28
- 陈雪梅课题组鉴定了一个新的非典型帽子修饰RNA(NAD-capped RNA)脱帽酶,揭示了NAD+帽子修饰参与基因表达调控的新机制2024.03.18
- 祝贺瞿礼嘉教授成果入选 2023 年度“中国生命科学十大进展”2024.03.08
- 李晴、高宁及合作者揭示亲本组蛋白在DNA复制叉回收的关键分子机制2024.03.07
- 伊成器课题组开发升级版RNA编辑技术RESTART v32024.03.06
- 魏文胜课题组揭示肿瘤逃逸非HLA-I类分子依赖多效型T细胞杀伤的新机制2024.02.21
- 秦跟基课题组与合作者揭示水稻花药适时开裂的分子机制2024.02.21
- 陆剑课题组发表综述探讨新冠病毒刺突蛋白的功能演化2024.02.20
- 李磊课题组与合作者揭示巨胞饮的转录调控机制2024.02.19
- 焦雨铃课题组与合作者完成首个多细胞植物染色体的部分设计与合成2024.01.27